
药学院戴建君/鞠艳敏团队在Advanced Functional Materials发表噬菌体精准抗菌疗法的最新研究成果
中国药科大学戴建君/鞠艳敏团队在学科顶尖期刊Advanced Functional Materials上发表了题为“Precision-Guided Killer” Engineered Phage for Combating Carbapenem-Resistant Klebsiella Pneumoniae Induced Inflammatory Bowel Disease的最新研究成果。中国药科大学2021级博士生竺佳颖和2023硕士生刘扬悦为论文的共同第一作者,中国药科大学戴建君教授,南通大学诸葛祥凯副教授,中国药科大学药学院徐莉莉副教授、鞠艳敏副研究员为通讯作者,中国药科大学为论文的第一通讯单位。
炎症性肠病(Inflammatory bowel disease,IBD)是一种自身免疫性炎症性疾病,其特征是不受调节的固有和适应性免疫反应导致持续的组织损伤。当肠道微生物群紊乱时,耐碳青霉烯类肺炎克雷伯菌(Carbapenem-resistant Klebsiella pneumoniae,CRKP)倾向于在结肠定植,并在遗传易感的宿主中引起严重的肠道炎症。噬菌体作为潜在抗菌药物替代疗法,已在多国获批用于治疗耐药菌感染的临床试验。噬菌体凭借靶向细菌的特性,在治疗CRKP感染的IBD中展现出可局部复制和调节菌群等优势。但由于细菌对噬菌体的耐受性及IBD引发的肠道免疫紊乱,传统噬菌体疗法存在细菌清除效率降低与治疗失败的局限性。因此,增强噬菌体抗菌及清除活性氧的能力,可作为攻克感染性IBD的关键策略。
针对上述临床挑战,团队借助二氧化铈(CeO2)纳米药物的抗炎和抗菌能力,对我国优势流行ST11 KL64型CRKP的烈性噬菌体进行工程化改造。结果表明,该工程化噬菌体具有强大的抗菌、抗生物膜和抗炎能力。工程化噬菌体通过识别细菌荚膜多糖及外膜蛋白实现靶向选择ST11 KL64型CRKP菌株。该工程化噬菌体可精准调节宿主基因表达,利用宿主菌的合成机制完成子代噬菌体繁殖,同时显著抑制能量和氨基酸代谢相关基因的转录,进而诱导ST11 KL64型CRKP的死亡。进一步的研究表明,工程化噬菌体能够选择性抑制小鼠肠道致病菌增殖并促进有益菌生长,有效重塑肠道微生态平衡,恢复肠道屏障。综上所述,本研究为开发噬菌体精准抗菌疗法提供了新策略。
该研究工作获得了国家自然科学基金(项目编号:32172855、31702252)和江苏省重点研发计划(现代农业)(项目编号:BE2022329)的支持。
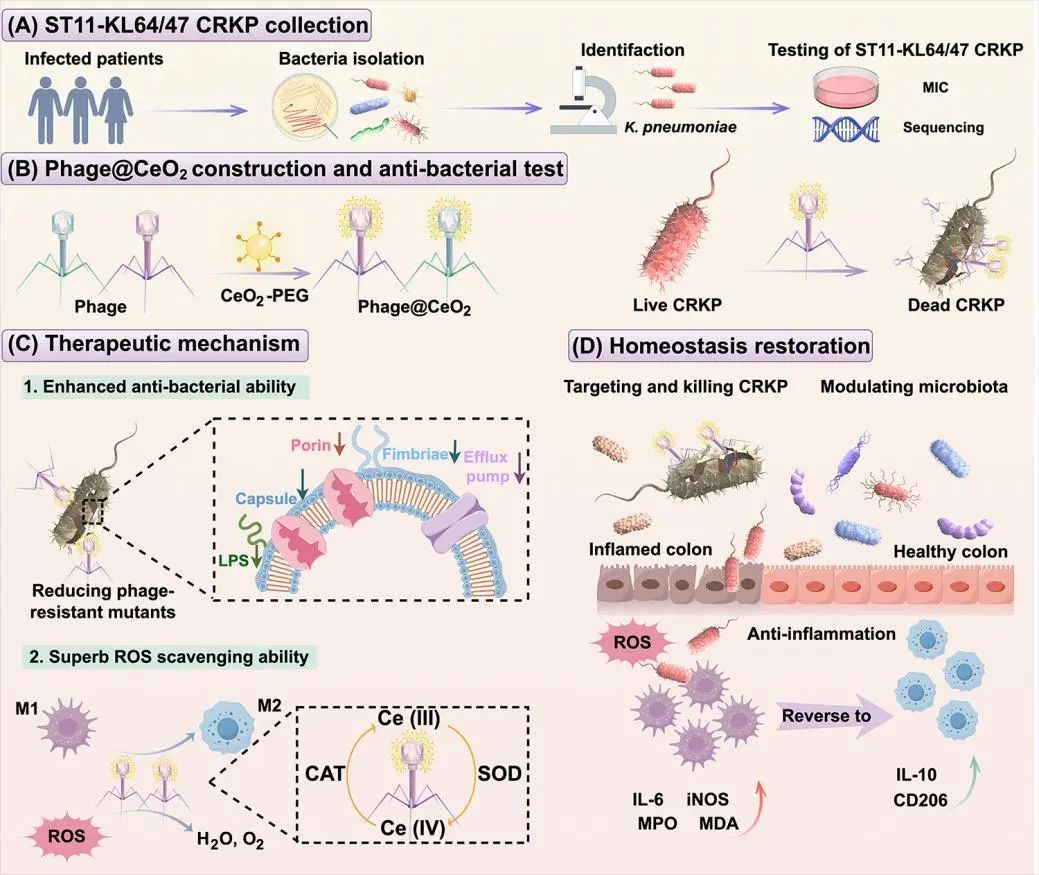
工程化噬菌体Phage@CeO2用于治疗感染性肠炎的示意图
药学院姜正羽/郭小可/尤启冬团队在Angew Chem 发表主客体桥接蛋白降解新策略研究成果
中国药科大学药学院姜正羽/郭小可/尤启冬团队在权威期刊Angewandte Chemie International Edition在线发表题为Supramolecular Host-Guest Assemblies for Tunable and Modular Lysosome-Targeting Protein Degradation的研究论文。中国药科大学药学院博士后陈学涛、2022级硕士研究生吴婷婷和陈亚力为本文共同第一作者,姜正羽教授、郭小可研究员和尤启冬教授为共同通讯作者,中国药科大学为论文唯一完成单位。
靶向蛋白降解技术已成为小分子药物开发的重要前沿方向,尤其是以PROTACs和LYTACs为代表的异源双功能分子策略,为传统“不可成药”靶点的干预提供了全新路径。其中,LYTACs通过招募溶酶体途径实现胞外或膜蛋白的降解,但其依赖固定共价连接的构建模式,在结构优化、靶点切换与时空调控方面存在显著局限。针对上述挑战,团队提出并构建了一种基于超分子主客体相互作用的新型降解系统——Host–Guest Bridged Lysosome-Targeting Chimeras(HGTACs)。该系统利用β-环糊精(β-CD)与金刚烷(Ada)之间稳定可逆的非共价识别作用,首次实现了靶向目的蛋白识别模块与溶酶体导向模块的动态装配与解耦,使得降解剂可根据靶点需求快速组合、灵活调节并精细控制降解效率。
该研究提出了一种模块化、可逆、可调控的新型蛋白降解策略,成功突破了传统LYTAC共价连接构型的设计瓶颈,为靶向降解胞外与膜蛋白提供了更具灵活性的新范式,对拓展主客体化学在药物开发中的应用具有重要意义。
本工作得到国家自然科学基金、江苏省基础研究计划、中国药科大学兴药学者计划、中央高校基本科研业务费、中国博士后科学基金等资助;获得江苏省创新药物设计与成药性优化重点实验室和多靶标天然药物全国重点实验室平台支持。
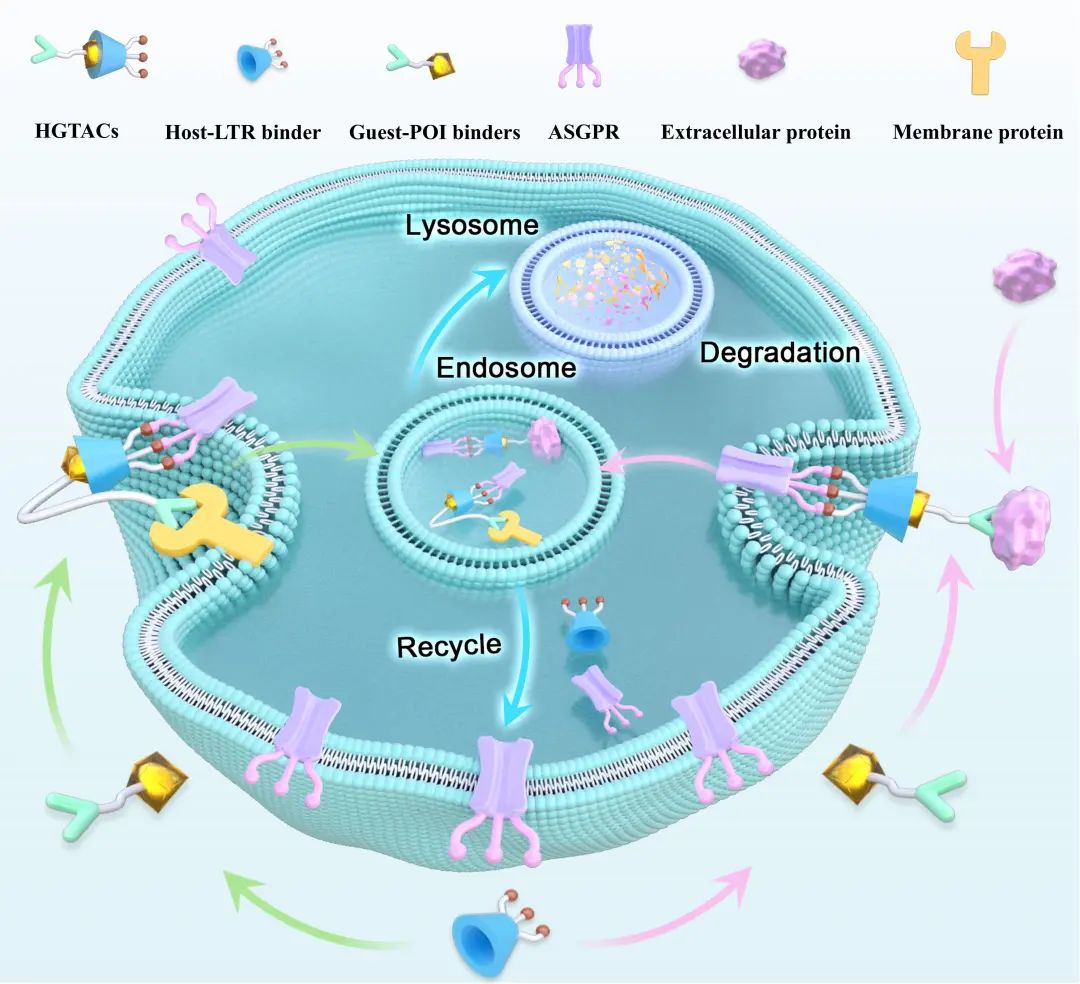
示意图
药学院戴建君/鞠艳敏团队在Advanced Science发表细菌性眼内炎治疗的最新研究成果
中国药科大学戴建君/鞠艳敏团队在学科顶尖期刊Advanced Science上发表了题为A Tailored Artificial Biocatalyst for Bacterial Endophthalmitis Therapy via Enhanced Ferroptosis-Like Death的最新研究成果。药学院2021级博士生孙彩霞为论文的第一作者,戴建君教授和鞠艳敏副研究员为论文的通讯作者,中国药科大学为论文的唯一通讯单位。
细菌性眼内炎是一类由葡萄球菌等细菌感染引起的眼科急危重症,由于病程发展迅速,患者若未得到及时有效的治疗,视功能将永久丧失。经验性注射万古霉素是目前临床首选治疗措施,但存在诱导细菌耐药和视网膜损伤的风险。虽然目前基于纳米药物的抗生素替代疗法在细菌感染性疾病治疗领域广受好评且已取得令人振奋的疗效,然而,细菌性眼内炎独特的疾病特征使得它们大多不适用该类疾病的治疗。一是起病急骤且发病迅速,不仅要求及时地治疗,而且要求治疗药物起效快、疗效高。二是眼部结构特殊,由于眼内光感受器和其他视网膜细胞对外界刺激具有超高的敏感度,故高给药剂量存在视网膜损伤的风险。此外,高频次玻璃体内注射也会增加眼内感染的风险。因此,目前迫切需要开发一种高效且适合治疗细菌性眼内炎的新型抗菌策略。
为了应对这一挑战,团队提出了一种基于细菌特异性人工生物催化剂(MFBH)的生物靶向催化策略,用于治疗细菌性眼内炎。结果表明,MFBH对标准和临床分离的金黄色葡萄球菌菌株均表现出高效的肽聚糖靶向催化抗菌能力。值得注意的是,体内实验结果表明,MFBH的治疗效果与万古霉素相当且不会引起视网膜损伤。机制分析表明,MFBH通过加速活性氧(ROS)爆发诱导增强的类铁死亡样细菌杀伤。进一步的研究表明ROS的产生与暴露在人工生物催化剂表面的硫空位及Mo4+密切相关。综上所述,这种细菌特异性人工生物催化剂为治疗眼内炎提供了一种很有前途的策略。
该研究工作获得了国家自然科学基金(项目编号:32172855)、中央高校基本科研业务费专项资金(项目编号:2632024ZD07、2632024TD02)等项目的支持。
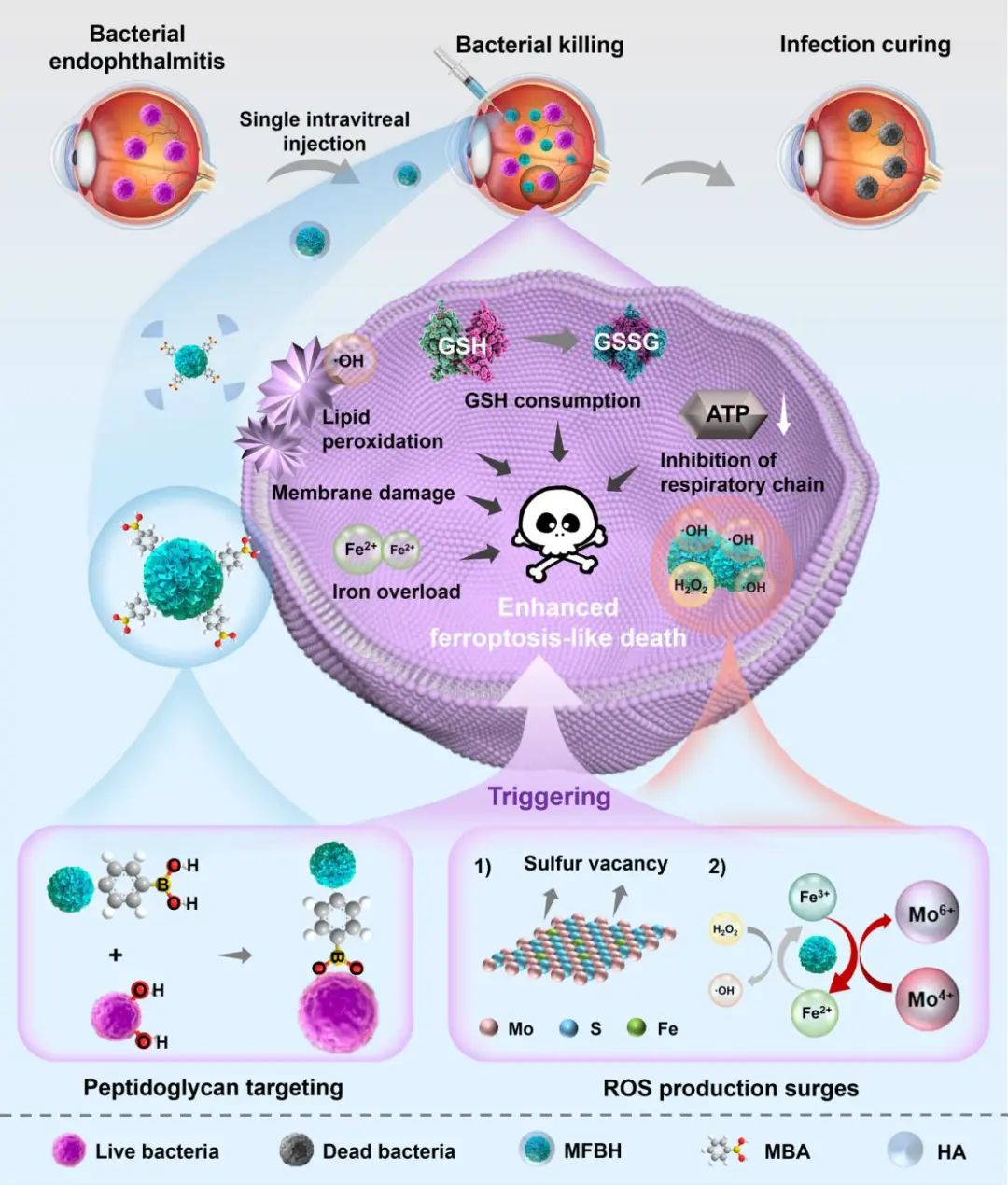
MFBH用于治疗细菌性眼内炎的示意图
① 凡本站注明“稿件来源:中国教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:中国教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 教育在线
教育在线


