“人的一生总不会一帆风顺,需要平常心对待,以免因过多的压力陷入焦虑。”这恐怕是现代社会人们听得最多的一句忠告了。
科学技术和物质文明高度发达的今天,人们内在平和与快乐的情绪却没有跟随着增长,几乎每个人都或多或少感到压力,长期的心理压力,会增加抑郁和焦虑的患病风险。而严重的焦虑会把人拖入烦恼的恶性循环,从精神和肉体方面产生不断的内耗,最终造成难以挽回的损伤。此前,科学界一般主要认为抑郁症、焦虑症等心理疾病的“元凶”在中枢神经系统本身,较少关注生物体的其他组织器官在此过程中扮演的角色。
近日,浙江大学生命科学研究院靳津实验室研究发现,CD4+T细胞嘌呤合成代谢功能紊乱在慢性应激诱导的心理疾病中的重要作用。这对加深神经发育、精神疾病与免疫生理功能之间联系的理解,对了解抑郁症和焦虑症的发病机制并研发新的药物具有重要意义。
北京时间2019年10月31日23时,相关研究成果以Stress-induced metabolic disorder in peripheral CD4+ T cells leads to anxiety-like behavior为题,在国际顶级学术期刊Cell在线发表。浙江大学生命科学研究院博士研究生范柯琪与李异媛博士为论文的共同第一作者,浙江大学靳津教授与东南大学柴人杰教授为论文的共同通讯作者。
变废为宝,剧情反转
CD4+T细胞主要存在于血液及各外周免疫器官中,主要功能是免疫监控和宿主防御,在B细胞抗体的生成和CD8+T细胞的活化中发挥着重要的辅助功能。细胞中的线粒体为生命活动提供了能量,对于细胞的正常发育与维持至关重要。
早在2017年,靳津实验室就开始寻找线粒体形态与免疫应答之间的关系,虽然发现线粒体可以调控先天免疫细胞白介素-12(IL-12)的表达,但与T细胞介导的炎症性疾病没有明显的相关性,实验也就进入停滞状态。此时另一个课题组正在开展对于听觉作用机制的研究,靳津课题组与他们分享了T细胞特异性线粒体分裂的实验小鼠,以便接受更多的检测。对方课题组发现了一个意料之外的现象,这批原本计划作为正常听力对照组的小鼠表现出听觉能力的严重下降。
“会不会是检测出错了?”靳津教授回忆起当时,大家的第一反应是很惊讶,因为此前还没有任何研究表明在没有炎症的情况下,T细胞特异线粒体分裂小鼠会出现听力衰退这种神经性疾病。在多次的检测之后,研究人员确认了实验结论的真实性和稳定性。“听觉能力与中枢神经有关,我们猜测到或许这类小鼠同时有着精神系统方面的疾病。”根据靳津教授的这项猜测,实验组取回这些小鼠,利用各种动物行为学实验对小鼠进行了关于学习记忆、焦虑抑郁、社交能力等方面的检测。实验结果非常引人关注,小鼠体内的CD4+T细胞在线粒体碎裂的状态下,会导致小鼠表现出严重的焦虑行为。
研究人员同时还尝试给实验小鼠施加各种外源性的压力刺激,检测了小鼠在慢性应激压力后的行为改变,他们惊奇地发现,T细胞在这些压力中导致的焦虑行为中扮演了不可或缺的重要角色。靳津表示,这项研究表明了焦虑这类神经系统疾病与免疫系统的紧密联系。
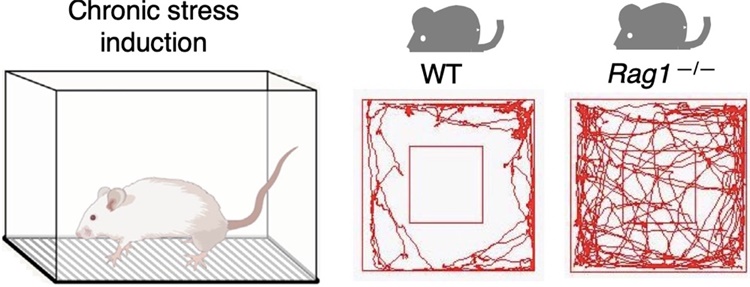
图1. 慢性应激后普通小鼠不敢探索空旷场地,缺少T细胞的小鼠无此表现
“长臂管辖”,直达恐惧中心杏仁核
CD4+T细胞在正常状态下,是保护生物体健康的守卫者,这次实验组发现的,就是T细胞“临阵倒戈”,引发焦虑这种负面状态的现象。根据已有的研究,中枢神经系统是免疫豁免器官。因为中枢神经系统非常重要,为了免遭外界影响,动物体进化出了血脑屏障,将外周免疫细胞挡在神经中枢外部,防止这些外周免疫细胞干扰神经元的正常工作。
那CD4+T细胞是如何穿越血脑屏障、“长臂管辖”神经中枢的呢?原来,在正常情况下,线粒体会促进葡萄糖通过糖酵解模式实现放能,使葡萄糖水解后变成丙酮酸,进入三羧酸循环为细胞正常运行提供能量。科研人员发现,在线粒体碎裂的CD4+T细胞内,葡萄糖并未通过正常的糖酵解途径代谢,而是通过戊糖五磷酸途径合成了大量嘌呤类物质(黄嘌呤)释放到细胞外。不同于T细胞本身,这些黄嘌呤可以轻松地通过血脑屏障,到达大脑的情绪处理中心——杏仁核。黄嘌呤通过细胞表面的嘌呤受体作用于杏仁核中的少突胶质细胞,引起少突胶质细胞的异常活化与增殖,最终造成恐惧中心局部神经元的过度活跃,引发小鼠严重的焦虑行为。
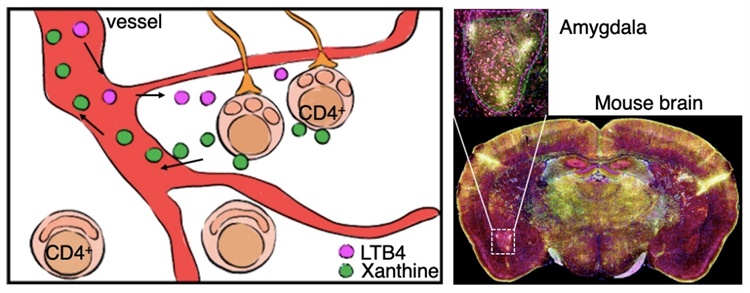
图2. 线粒体碎裂的CD4+T细胞产生黄嘌呤,进入血液循环后影响杏仁核
技术进步让科学家看得更清晰
免疫系统如何干预神经系统?最初,靳津实验室对解答这个问题也并没有足够的把握。随着高通量测序技术的不断发展与完善,整合多种组学数据的技术也日趋成熟。于是,科研人员通过一系列组学的大数据工具,绘制了一张免疫-大脑图谱,尝试按图索骥找到CD4+T细胞的作用模式,进而找到T细胞与神经系统之间联系的蛛丝马迹。
“脑部细胞类型众多,没有单细胞测序的帮助下,很难知道T细胞来源的黄嘌呤作用于谁,引起了脑部怎样的变化。”靳津表示,多组学工具,让原本只能管中窥豹的科学家们,能从一个更大的视野去看待这些生理变化和细胞之间的相互关系。
“随着技术的进步,我们对大脑的分析结果从只能看到一团细胞,到能够看清每一个细胞所处的状态。这有助于我们发现早期很难认识到的新信息。借由此技术,我们也发现了外周T细胞与少突胶质细胞之间的紧密联系”靳津说。
那是不是只要观察手段的进步,很多科学研究就能迎刃而解?
答案是否定的,靳津认为,要有明确的科学问题作为导向,加之用好科学工具,才能事半功倍。
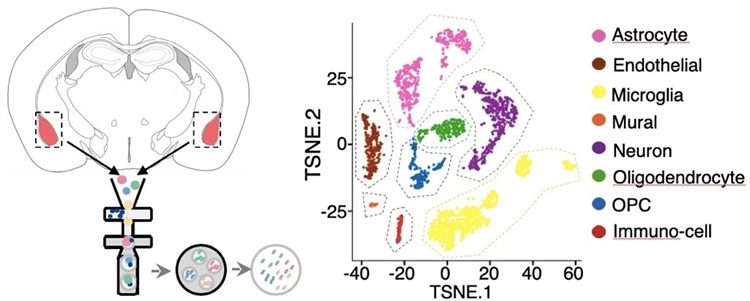
图3. 利用单细胞测序技术绘制大脑单细胞图谱
为未来焦虑症药物研发推开一扇新大门
多位科学家独立审查了这项工作,他们一致认同这项工作具有重要的潜在意义。哈佛医学院的研究者认为:“作者发现了通过靶向药物抑制CD4+T细胞黄嘌呤合成,从而对中枢神经系统的神经回路功能进行调节的可能性,为那些因免疫系统失调而导致精神疾病症状的患者提供了精准治疗设计的方向。”
靳津分析说,未来临床上可以设计一些血液检测的量化指标用于评判焦虑症的严重程度,也能给治疗效果提供一个客观的评价,与目前临床上通过问卷填表的录入方式相结合,可以使病情判断更加准确。
这项研究的另一个重要作用还在于焦虑症药物的开发。目前焦虑症的大多数治疗药物直接靶向中枢神经系统,常伴随严重的副作用,对多区域的神经元都有影响,如果能进一步找到特异的T细胞,通过外周的靶点实现对焦虑或者抑郁症的干预,就能为临床医学药物研发推开一扇新的大门。
对于研究的应用,靳津还有更深一步的考虑。目前有数据显示,在患有肠易激综合征的病人中,有高达30%左右的患者同时伴有严重的焦虑症状,但其背后的机制不明,一直困扰着临床的治疗医师。靳津组研究发现在这类病人外周血内同样检测到黄嘌呤水平的上升,因此该研究可能为临床多种疾病状态下伴随性精神疾病的治疗提供潜在的干预靶点。靳津表示,希望未来能给焦虑症等精神类疾病画一张更大的地图,更加清晰地描绘多系统如肠道菌群、代谢改变、免疫反应和中枢神经间的相互关系,为最终攻克解决严重焦虑症提供更加精准的解决方案。
① 凡本站注明“稿件来源:教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 教育在线
教育在线




