5月27日,北京大学化学与分子工程学院、前沿交叉学科研究院生命科学联合中心陈鹏教授课题组和王初教授课题组的合作成果以“Machine-learning-assisted universal protein activation in living mice”为题在《细胞》(Cell)杂志在线发表。
两个课题组通过持续的深入合作,开发了融合“机器学习与生物正交剪切反应”的蛋白质活体激活技术,实现了“邻近脱笼”策略从活细胞向活体动物的突破。
该工作通过机器学习与生物正交剪切反应融合驱动,获得了一种创新的蛋白质原位激活平台技术CAGE-Proxvivo,能够在活体动物中瞬时激活目标蛋白质的功能,并精确调节蛋白-蛋白相互作用。此外,CAGE-Proxvivo还可以调节细胞表型,诱导肿瘤细胞发生焦亡,增强抗肿瘤免疫响应。
CAGE-Proxvivo技术使得生物正交剪切反应迈入了“任意蛋白+活体应用”的新时代,相当于找到了一把“万能钥匙”,可以随心所欲地调控蛋白质的活性。这标志着活体化学反应发展的重要突破,不仅为动态生物学过程的原位研究提供了强大工具,也为按需式精准治疗开辟了新的途径。

论文截图
什么是生物正交反应?
生物正交反应是指可以在生物体系中进行且不与内源生命过程相互干扰的化学反应。这类反应的发展,不仅拓展了传统有机化学反应的生物学应用边界,也将合成化学的逻辑引入生命系统研究,革新了生命过程的分子解析与精准调控方式,为揭示复杂生理、病理机制提供了全新视角。
以“点击化学”为代表的生物正交反应因为有效解决了复杂生命体系中特定生物分子的原位标记与示踪等关键科学难题,获得了2022年度诺贝尔化学奖,但这一以“偶联”为核心的化学反应模式仍存在局限,难以实现对生物大分子功能的调控和解析。
陈鹏课题组长期致力于“活细胞化学反应”的开发与应用,在国际上率先提出并发展了基于“断键”化学的生物正交反应——生物正交剪切反应(Bioorthogonal Cleavage Reaction, Nat. Chem. 2014, 6, 352.)。与传统的“连接”反应不同,这种剪切反应通过化学键的断裂,实现对靶标分子中掩蔽基团的时空可控释放。
该策略突破了利用化学反应调控生物大分子功能的技术瓶颈,实现了蛋白质在活细胞等环境中的精准“脱笼”和激活,使得生命过程和分子互作在特定的时间和空间内被精确开启,为活细胞的功能研究开辟了新的途径。
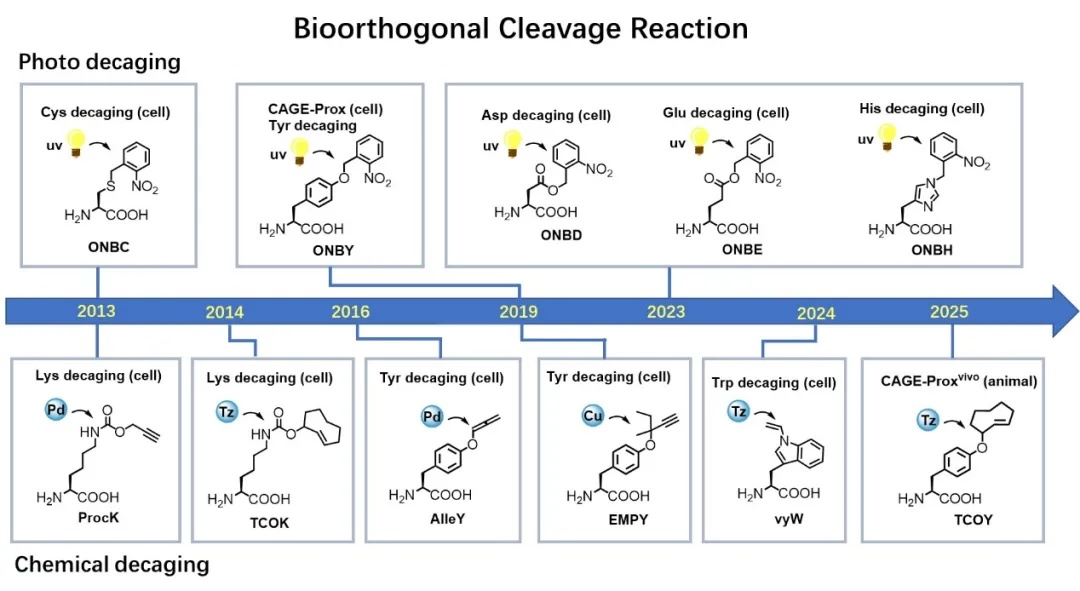
化学(光)脱笼生物正交剪切反应的发展历程
什么是“脱笼”?
“化学脱笼”策略是一类适用性广、干扰度低的蛋白质激活方法,通过对酶的关键催化残基的保护和脱保护,可以实现对其活性的“关-开”调控。陈鹏课题组先后在赖氨酸、酪氨酸等活性氨基酸侧链上实现了生物正交断键反应和脱笼,在活细胞及活体动物内实现了蛋白激酶等多种蛋白质的特异激活。
然而,受限于可以进行脱笼反应的非天然氨基酸类型,上述基于催化残基的“直接脱笼“策略只能在某些特定蛋白家族中应用。如何进一步发展广泛适用于不同类型蛋白家族的原位激活方法,在活体环境内研究蛋白质动态功能变化,是众多化学生物学研究者力图实现的重要目标。
2019年,陈鹏课题组与王初课题组合作,利用紫外光控的生物正交剪切反应为活细胞内的蛋白质安装了功能开关。这一被称为蛋白质“邻近脱笼”(CAGE-Prox)的策略具有很强的普适性,实现了活细胞内各种酶家族蛋白质的瞬时激活(Nature. 2019, 569, 5095)。
最新的“脱笼”策略有哪些改进?
在《细胞》发表的工作中,作者结合逆电子需求Diels-Alder反应(IEDDA),将其应用于反式环辛烯-酪氨酸(TCOY)的保护和脱保护,并通过蛋白语言模型训练机器学习算法,捕捉序列特征与蛋白质功能之间的相关性,辅以Rosetta软件对接模拟酶和底物的相互作用,从而提高了tRNA合成酶(PylRS)变体选择的成功率,最终实现了TCOY的识别和编码表达。
这一“化学开关”的引入,能够暂时关闭目标蛋白质的功能,并可通过小分子诱导的生物正交剪切反应在体内原位恢复,实现可控激活,获得了适用于活体动物的通用蛋白质激活策略(CAGE-Proxvivo)。
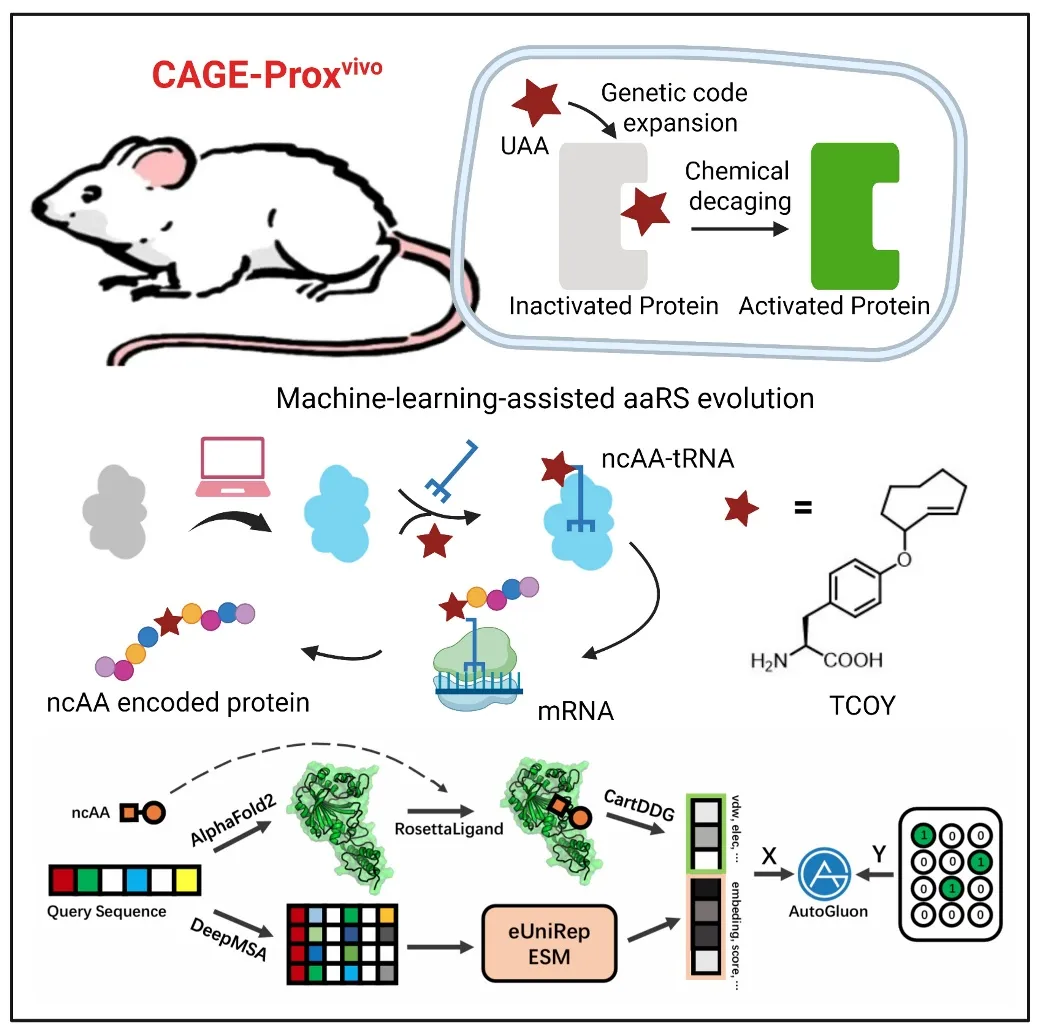
机器学习驱动的蛋白质活体激活策略:通过蛋白语言模型训练机器学习算法,设计和筛选tRNA合成酶(PylRS)变体,实现了可化学脱笼的反式环辛烯-酪氨酸(TCOY)的识别和编码表达,用于后续在体蛋白质功能激活和互作调控
新的“脱笼”策略能做啥?
在建立CAGE-Proxvivo标准流程后,作者将其应用于蛋白质靶向递送与激活治疗。作者巧妙地设计了靶向递送与化学激活的双重控制,构建了“蛋白质前药”系统,利用靶向递送,实现了炭疽致死因子(Lethal factor)的可控、原位激活,有效抑制了实体肿瘤的生长。
在此基础上,作者通过CAGE-Proxvivo策略成功实现了细胞焦亡(pyroptosis)在肿瘤内部的可控-特异诱导。细胞焦亡作为一种由Caspase介导的炎症性细胞死亡方式,因其激活免疫应答的潜力而备受关注。尽管传统化疗药物能诱导细胞焦亡,但鉴于GSDME在许多肿瘤细胞中的低表达,肿瘤特异性诱导焦亡仍面临重要挑战。CAGE-Proxvivo技术则在小鼠肺癌细胞中引发了Caspase-3依赖性GSDME切割,诱导细胞焦亡,触发免疫杀伤,有效抑制了继发肿瘤的生长。作者进一步扩大了该策略的应用范围,在多种肿瘤细胞中展示了细胞焦亡介导的免疫治疗潜力。
此外,作者通过改进计算建模流程,将“化学开关”从酶活口袋拓展至蛋白质到互作界面,实现了蛋白–蛋白相互作用的精确调控,并开发了生物正交“门控”双特异性抗体,用于肿瘤免疫治疗。在该应用中,作者通过遗传编码将TCOY引入抗CD3抗体(aCD3),并将其与肿瘤靶向模块结合,构建了具有条件性激活能力的“开关”型T细胞接合器(T cell engager, TCE)。随后通过活体生物正交剪切技术恢复T细胞活性,精确激活肿瘤部位的T细胞,有效避免了系统性细胞因子释放综合征(CRS)及其引发的毒性反应,提高了治疗安全性,为在实体瘤的免疫治疗中,将免疫原性低的“冷”肿瘤转变为高免疫原性的“热”肿瘤提供了新的途径。
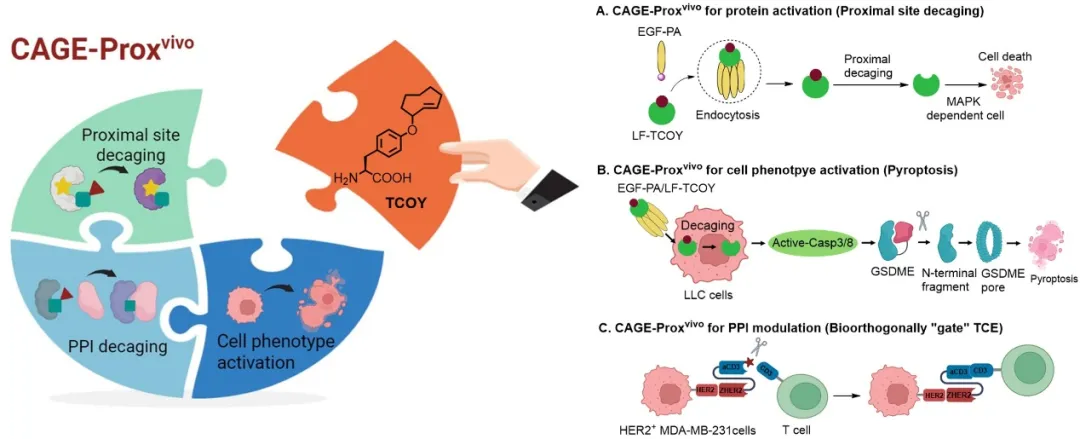
CAGE-Proxvivo蛋白质活体原位激活通用平台应用:在活体动物中按需激活蛋白质功能;调节细胞表型,诱导肿瘤细胞发生焦亡,增强抗肿瘤免疫反应;精确调节蛋白质-蛋白质相互作用,实现生物正交“门控”双特异性抗体,用于按需招募和激活T细胞
除TCOY外,作者基于统一的机器学习模型成功进化出可识别反式环辛烯-半胱氨酸(TCOC)的PylRS变体,并通过CAGE-Proxvivo策略实现了半胱氨酸的可控化学遮蔽以及活体内蛋白功能的精准调控。该研究进一步展示了结合蛋白质语言模型与结构建模特征的混合策略在底物谱拓展中的有效性和普适性,有望实现更多天然氨基酸的遮蔽-脱笼,为活体内生物大分子功能和生命过程的精准操控建立通用平台。
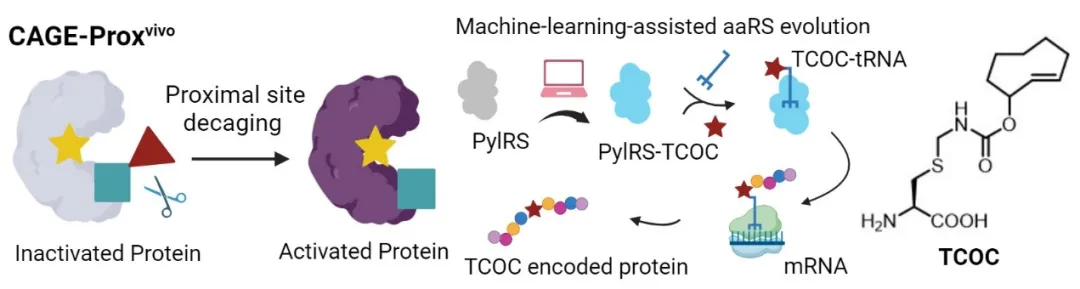
机器学习模型成功进化出可识别反式环辛烯-半胱氨酸(TCOC)的PylRS变体,并通过CAGE-Proxvivo策略实现了半胱氨酸的可控化学遮蔽以及活体内蛋白功能的精准调控
陈鹏、王初为本文的共同通讯作者。北京大学前沿交叉学科研究院已毕业博士研究生汪欣(现深圳湾实验室博士后)、北京大学化学与分子工程学院副研究员刘源为本文的共同第一作者。
本工作获得科技部、国家自然科学基金委、北京分子科学国家研究中心、新基石基金会和北京大学AI4S等项目的支持。
① 凡本站注明“稿件来源:教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。






 教育在线
教育在线



