疟疾(Malaria)是疟原虫(Plasmodium)通过雌性按蚊为媒介传播的传染性疾病,是当今世界公共卫生的突出问题。可寄生于人类的疟原虫有5种,包括恶性疟原虫(Plasmodium falciparum)、卵形疟原虫(Plasmodium ovale)、间日疟原虫(Plasmodium vivax)、三日疟原虫(Plasmodium malariae)和诺氏疟原虫(Plasmodium knowlesi)。其中恶性疟原虫可感染各个时期的红细胞,引起严重的全身症状甚至导致死亡,是现存对人类健康威胁最大的疟原虫。
上世纪70年代,屠呦呦等中国科技工作者从黄花蒿中成功提取出抗疟效果良好的青蒿素化合物。至今以青蒿素为基础的药物联用疗法(Artemisinin-based combination therapy,ACT)仍旧是治疗恶性和重症疟疾的一线疗法,对全球的抗疟工作起到了突出贡献,屠呦呦也因此获得2015年诺贝尔生理与医学奖。然而由于耐药性疟原虫的产生,ACT疗法已先后在东南亚和非洲地区出现了治疗失败的病例,开发新型抗疟药物已成为亟需解决的重要科学和公共卫生问题。
葡萄糖是大多数动物细胞的主要能源物质,通过抑制细胞摄取葡萄糖的“饥饿疗法”,可作为治疗一些相关疾病的潜在治疗策略。在恶性疟原虫中,己糖转运蛋白PfHT1(Plasmodium falciparumhexose transporter 1)是其主要的葡萄糖摄入蛋白,通过抑制该蛋白的转运活性,将可能有效抑制疟原虫的能量摄入从而抑制原虫的生长和增殖,但是该策略的难度在于定向抑制疟原虫的糖摄入而不影响人体细胞。在早期针对PfHT1作为抗疟靶点的研究中,由于缺乏该蛋白的结构信息,抑制剂的开发工作没有取得突破性进步。原清华大学生命科学学院教授颜宁领导的团队在2014年和2015年相继解析了人源葡萄糖转运蛋白GLUT1和GLUT3的高分辨率晶体结构,与此同时将目标锁定PfHT1,并在结构解析的基础上与清华大学药学院尹航教授团队合作进行基于结构的小分子药物开发。
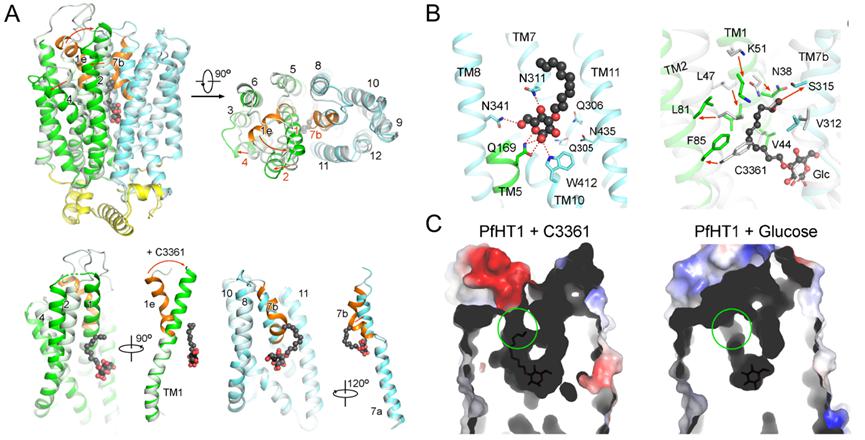
C3361别构抑制PfHT1并诱导产生新的空腔结构
(A)相比与底物葡萄糖结合的PfHT1蛋白构象,与抑制剂C3361的结合引起了PfHT1蛋白巨大的构象变化;(B)C3361分子在占据底物葡萄糖结合位点的同时在其尾部诱导产生了一个新的空腔;(C)葡萄糖/C3361分别与PfHT1结合构象下的空腔对比。
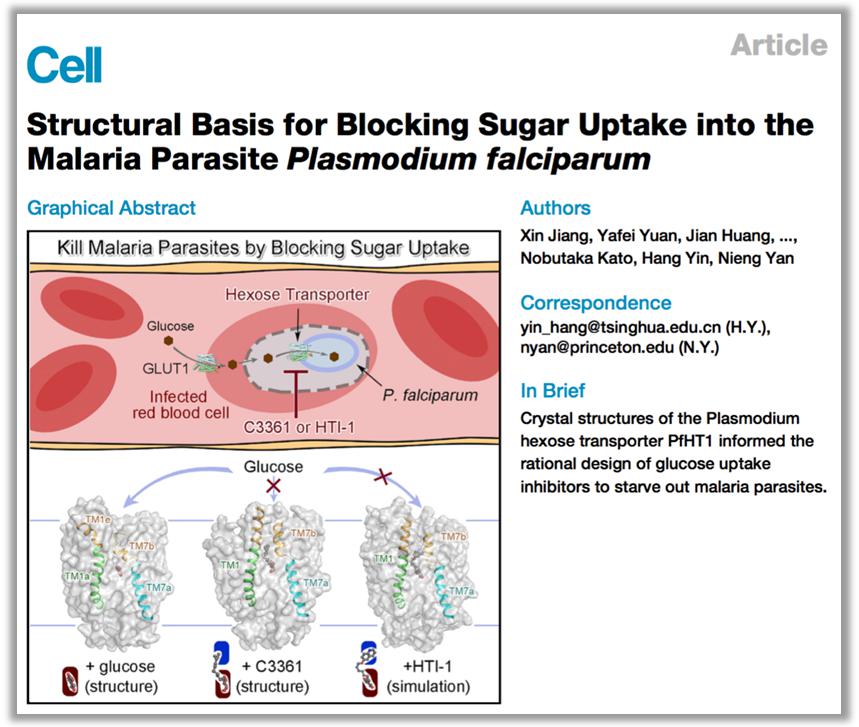
2020年8月28日,颜宁团队与尹航团队合作在国际顶级期刊《细胞》上在线发表题为《抑制恶性疟原虫糖摄入的结构基础》(Structural Basis for Blocking Sugar Uptake into the Malaria Parasite Plasmodium falciparum)的重要研究成果。
该论文报道了PfHT1分别结合天然底物葡萄糖和一个已知的选择性与抑制效果都比较微弱的抑制剂C3361的两个结构。出乎意料,C3361的结合导致了PfHT1巨大的构象变化,衍生出一个全新的空腔结构,可以用来作为靶点进行抑制剂的设计与优化。在此发现的基础上,团队成员开发出了一系列具有更高亲和力的选择性抑制剂,在原虫抑制实验中确认可以有效杀死疟原虫,却对人源细胞无害,从而为开发新一代抗疟药物开辟了道路。
在发表《细胞》论文的同时,两个团队还合作在生物领域预印本平台bioRxiv上发表了题为《靶向PfHT1蛋白正构-别构双位点的选择性抗疟药物开发》(Orthosteric-allosteric dual inhibitors of PfHT1 as selective anti-malarial agents)的研究成果。在这一文章中进一步详细阐明了新一代小分子抑制剂系列的设计思路和构效关系,并通过一系列的原虫抑制实验验证了该系列小分子抑制剂的高杀伤性、低细胞毒性以及针对原虫多个繁殖周期都具有良好抑制效果的多周期性,从而为该系列抗疟药物的进一步开发奠定了基础。
综上,研究团队针对疟疾耐药性不断增加的现状,通过对底物或抑制剂结合状态下的PfHT1蛋白结构解析,鉴定了新的药物结合位点并设计出一系列高效的“正构-别构”双位点抑制剂。通过抑制疟原虫对葡萄糖的摄取“饿死疟原虫”,这代表着一种新型抗疟药物研发思路,为下一代抗疟药物的研发奠定了基础。
中国科学院院士、清华大学饶子和教授表示:“研究团队以阻断疟原虫能源摄取为新手段开发的新一代化合物有望解决日趋严重的疟疾耐药性问题;同时靶向膜转运蛋白的正构及别构调节位点的抑制剂设计思路非常具有创造性,也为其他药物理性设计提供了参考”。
文章的共同通讯作者为原清华大学生命科学学院、医学院、现普林斯顿大学分子生物学系教授颜宁和清华大学药学院教授尹航,共同第一作者为现已毕业的清华大学生命科学学院博士蒋鑫、清华大学生命科学学院博士后袁亚飞、清华大学化学系2016级博士生黄健与清华大学生命科学学院2017级博士生张硕。
本研究历时多年,在此过程中经费来源于清华大学结构生物学高精尖创新中心、生物联合中心、膜生物学国家重点实验室、国家自然科学基金与北京高校卓越青年科学家计划项目的支持,实验受到全球健康药物研发中心(GHDDI)疟疾项目团队、日本SPring-8同步辐射中心、上海同步辐射光源(SSRF)以及清华大学蛋白质研究技术中心X射线晶体学平台、清华大学药学技术平台的支持。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(20)31006-0#
① 凡本站注明“稿件来源:中国教育在线”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:中国教育在线”,违者本站将依法追究责任。
② 本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。





 中国教育在线
中国教育在线



